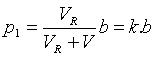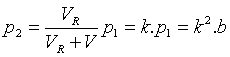7. Slitiny.
Fyzikální vlastnosti pevných látek (ale i kapalin a plynů) často značně závisí na přítomnosti cizích atomů, příměsí a nečistot. V případě pevných látek pak mluvíme o slitinách. Protože slitiny mívají v mnoha případech lepší vlastnosti než čisté látky, má jejich studium velký praktický význam.
7.1. Fáze a fázové přeměny.
Podle J.W.Gibbse zní definice fáze následovně: Jestliže soustava je v celém svém objemu jednolitá a to nejen po stránce chemického složení, ale i po stránce fyzikálního stavu, říkáme o ní, že je homogenní, nebo že se skládá z jediné fáze.
Pojem fáze může být názorně objasněn pomocí Obr.7.1.
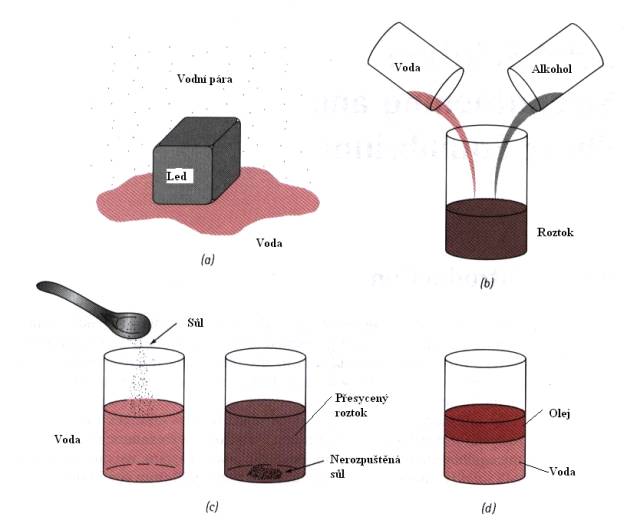
Obr. 7.1. K objasnění pojmu fáze.
Matematicky lze situaci na tomto obrázku charakterizovat tzv. Gibbsovým pravidlem fází:
F = C – P + 2 (7.1)
kde C je počet složek v soustavě, P je počet fází a F je počet stupňů volnosti (teplota, tlak, složení), které lze nezávisle měnit, aniž dojde ke změně rovnováhy fází. Jako příklad, na němž toto pravidlo objasníme, uvádíme fázový diagram čistého Mg (jednosložkový fázový diagram) – Obr.7.2.
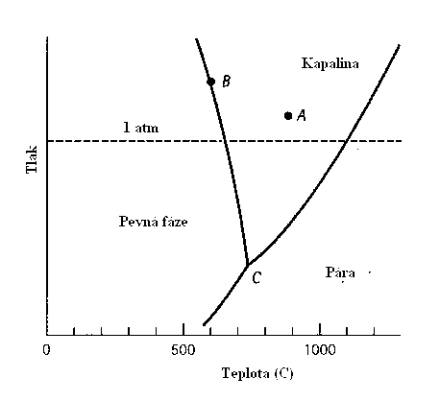
Obr.7.2. Fázový diagram hořčíku.
Předpokládejme nejdříve, že se soustava nachází při tlaku a teplotě, které odpovídají bodu A. Potom C = 1 (čistý Mg), P = 1 (kapalina), takže F = 1 – 1 + 2 = 2. Vychází nám tedy dva stupně volnosti a můžeme měnit buď teplotu, nebo tlak, nebo obojí a stále se budeme nacházet v „kapalné“ oblasti diagramu. Podobně máme pro bod B: C = 1, P = 2 (pevná a kapalná fáze) a tedy F = 1 (měníme-li např. tlak, bude se měnit zároveň i teplota – nacházíme se na křivce CB). Nakonec pro bod C máme C = 1, P = 3 a tedy F = 0 (trojný bod, daný pevnými hodnotami tlaku a teploty.
Podobně jako je tomu u kapalin (Obr.7.1), existují i u pevných látek tři případy rozpustnosti jedné látky ve druhé: úplná rozpustnost, částečná rozpustnost a nerozpustnost. Na Obr.7.3a,b. je znázorněn případ úplné a částečné rozpustnosti (Ni v Cu a Zn v Cu). Z tohoto obrázku vidíme, že v případě částečné rozpustnosti Zn v Cu vzniká jak tuhý roztok, tak i sloučenina CuZn (Obr.7.3c). Fázový diagram pro tuto slitinu je na Obr.7.4. Podmínky pro rozpustnost atomů A v atomech B jsme si uvedli v odstavci 4.1.2.
Rozpustnost v pevném stavu není omezena jenom na kovy. Na Obr. 7.5. je ukázán příklad úplné rozpustnosti v případě keramických materiálů MgO a NiO. Jedná se o úplnou rozpustnost proto, že obě sloučeniny mají stejnou krystalovou strukturu a blízké poloměry iontů i stejné mocenství.
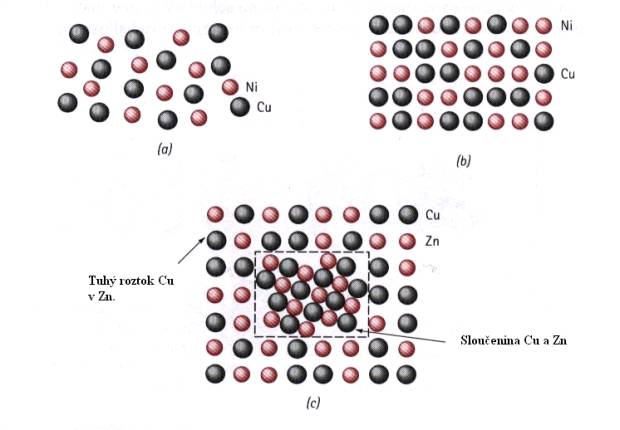
Obr.7.3. Úplná rozpustnost atomů Ni v Cu a částečná rozpustnost atomů Zn v Cu.
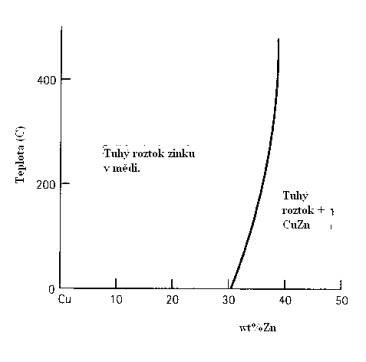
Obr.7.4. Fázový diagram slitiny CuZn
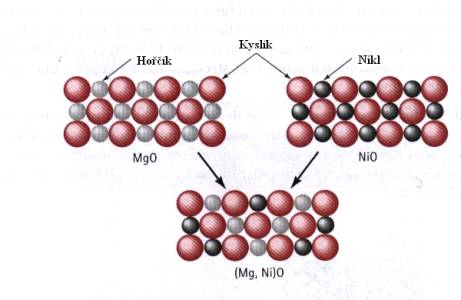
Obr.7.5. Příklad úplné rozpustnosti v případě keramických materiálů.
7.2. Binární slitiny v případě úplné rozpustnosti.
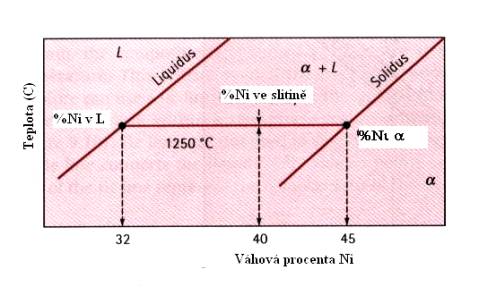
V případě úplné rozpustnosti jedné látky v druhé má fázový diagram v proměnných teplota – složení tvar, uvedený pro slitiny CuNi (Obr.7.6.). Jako liquidus je zde označena čára, rozdělující oblast kapalné fáze a oblast, v níž dochází ke krystalizaci pevné fáze (stále ve fázi kapalné). Solidus je název pro křivku, oddělující tuto posledně jmenovanou oblast od pevné fáze slitiny. Z Obr.7.6 plyne, že slitina Cu+40wt%Ni tuhne v oblasti teplot 1280 0C – 1240 0C. Písmenem a je označen tuhý roztok CuNi. Podobný fázový diagram má i slitina (Ni,Mg)O (Obr.7.7.).
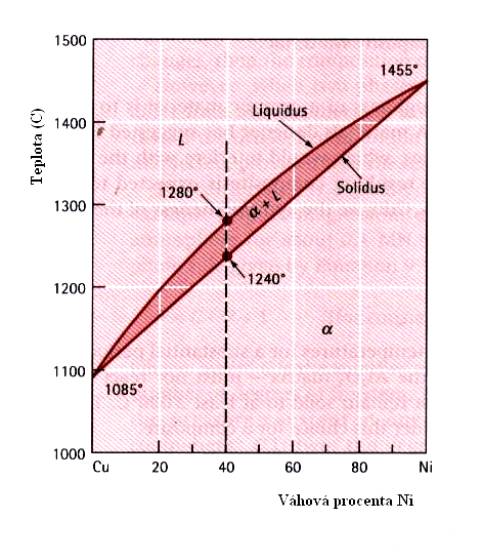
Obr.7.6. Binární slitina CuNi.
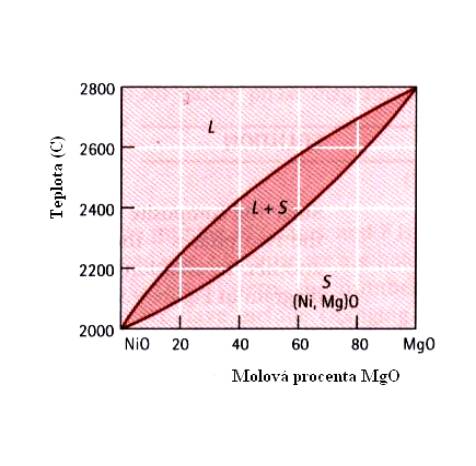
Obr.7.7. Fázový diagram slitiny (Ni,Mg)O – viz Obr.7.5.
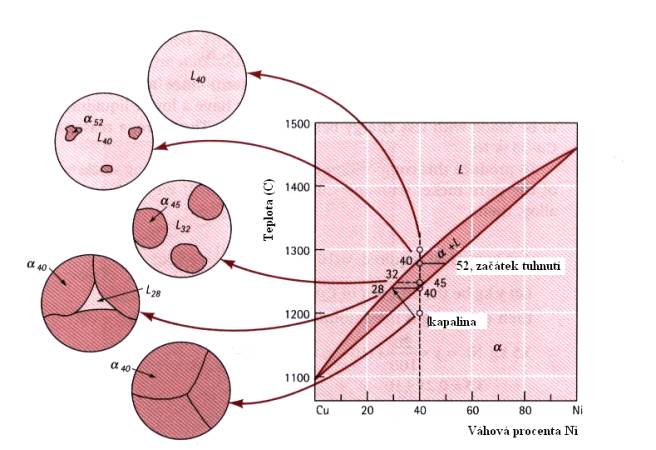
Jako příklad pro lepší pochopení použití fázového diagramu popíšeme složení slitiny Cu+40wt%Ni (známou z Obr.7.6) při teplotách 1300 0C, 1270 0C, 1250 0C a 1200 0C. Z Obr. 7.8 a 7.9. plyne, že při teplotě 1300 0C je slitina v tekutém stavu (tvoří jednu fázi – taveninu). Při teplotě 1270 0C, nacházející se v oblasti mezi liquidem a solidem dostáváme dvě fáze, tuhý roztok a-CuNi a kapalnou fázi této slitiny. Abychom popsali poměry v této oblasti, vedeme rovnoběžku s osou x (složení slitiny). Ta protne liquidus v bodě, odpovídajícím 37%Ni a solidus v bodě pro 50%Ni. Lze tedy říci, že pro teplotu 1270 0C se v roztoku slitiny CuNi začínají tvořit zmíněné krystalky a CuNi, přičemž kapalná fáze se ochudí o Ni (bude ho obsahovat jenom 37%) a naopak pevná fáze ho bude obsahovat více (50%). Při teplotě 1250 0C budou existovat opět dvě fáze, kapalná bude ještě chudší na Ni (pouze 32%) a pevná ho bude obsahovat 45%. Při teplotě 1200 0C dojde k úplnému ztuhnutí slitiny, která bude nyní obsahovat 40%Ni a 60%Cu.
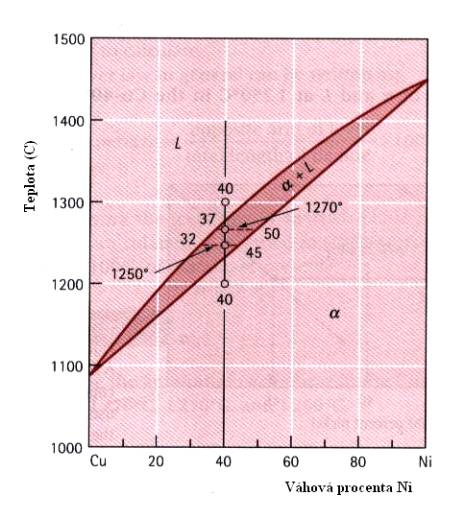
Obr.7.8. K objasnění možností fázového diagramu.
Obr.7.9. Detail z Obr.7.8.
Názorně je struktura, vznikají při tuhnutí slitiny CuNi, zobrazena na Obr.7.10. pro případ rovnovážného (pomalého) tuhnutí, kdy je umožněna dostatečná difúze atomů Cu a Ni, takže vznikne homogenní rovnovážná struktura slitiny. Pokud je tuhnutí nerovnovážné, je situace složitější a její výklad vychází za rámec této kapitoly.
Obr.7.10. Struktury, vznikající při tuhnutí slitiny CuNi.
7.3. Binární slitiny v případě částečné rozpustnosti.
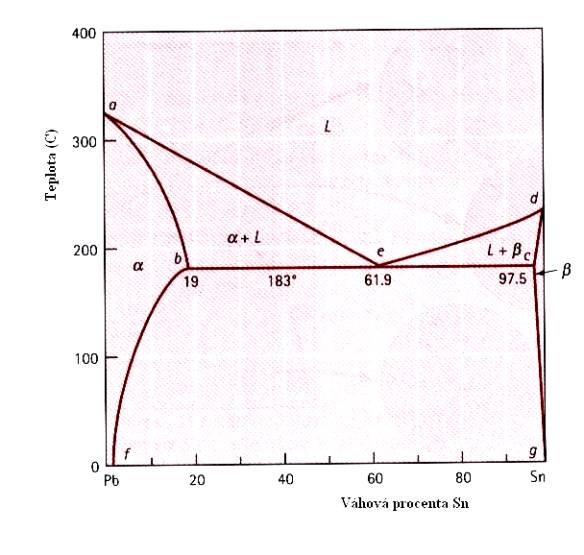
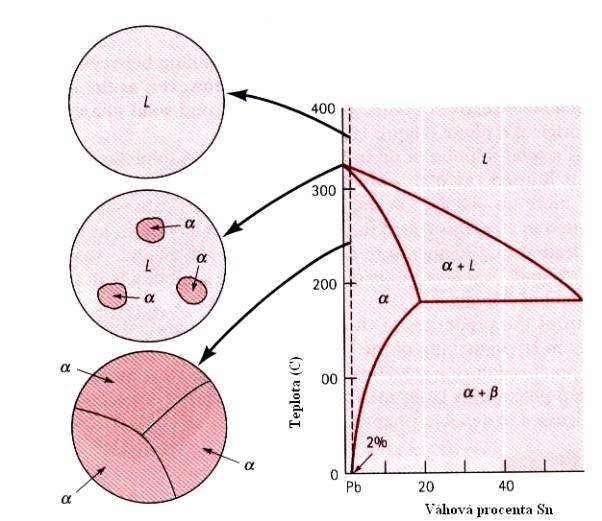
V případě částečné rozpustnosti má fázový diagram mnohem složitější tvar, který si názorně ukážeme na Obr.7.11. pro případ slitiny PbSn. Na Obr. 7.12. je podrobněji ukázán vznik struktury slitiny pro případ malých koncentrací Sn v Pb. Na dalším obrázku (Obr.7.13) je situace poněkud složitější (slitina Pb+10wt%Sn) – vznikají precipitáty (tzv. b - fáze), rozptýlené ve fázi a (tuhý roztok).
Zvláštním případem je tzv. eutektická slitina takového složení, že z kapalné fáze tuhne přímo pevná fáze, aniž tuhnutí prochází oblastmi, v nichž je tuhnoucí fáze obklopena fází kapalnou. (Obr.7.14). Složení eutektické slitiny ( v tomto případě Pb+61,9wt%Sn) má výraznou lamelární strukturu.
Obr.7.11. Fázový diagram slitiny PbSn (částečná rozpustnost).
Obr.7.12. Struktura slitiny PbSn pro malé koncentrace Sn v Pb.
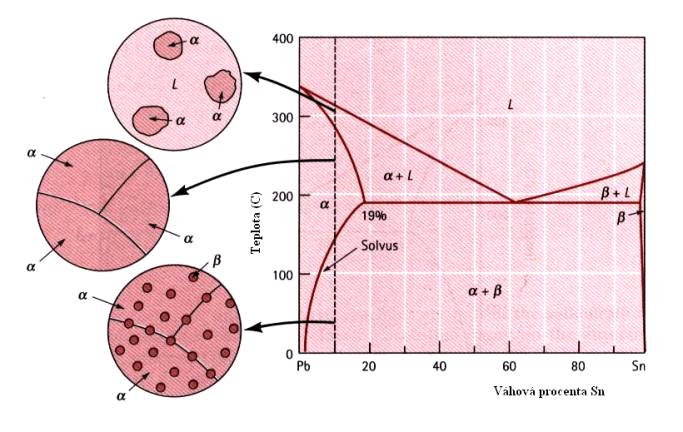
Obr.7.13. Struktura slitiny PbSn pro vyšší koncentrace Sn v Pb (kolem 10 wt% Sn)
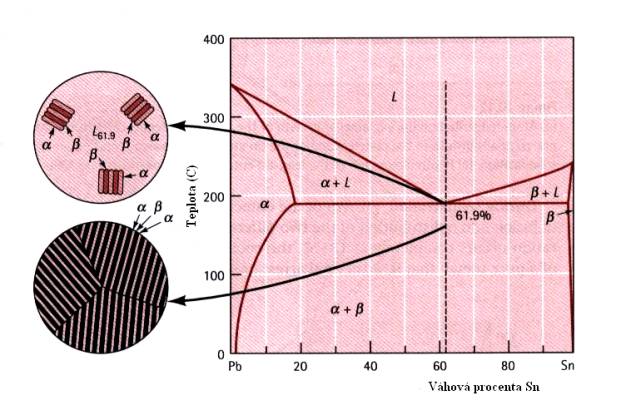
Obr.7.14. Struktura eutektické slitiny PbSn.
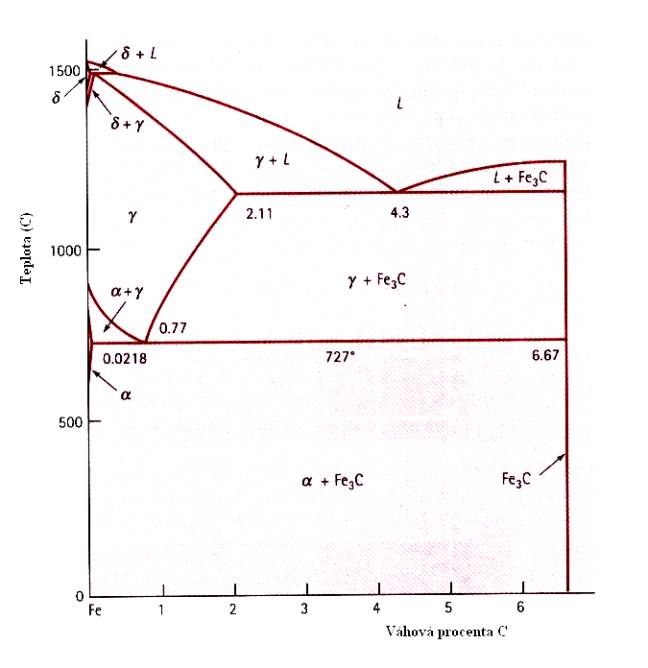
Obr.7.15. Fázový diagram technicky významných ocelí.
Ještě složitější situace nastává v případě, kdy je rozpustnost jednoho prvku velmi malá, jako je tomu v případě oceli (Fe + C). Fázový diagram pro technicky významné oceli je uveden na Obr.7.15. (pro vyšší koncentrace uhlíku dostáváme technicky nevyužívané slitiny, připomínající keramika či strusku). Z tohoto obrázku vidíme, že v případě ocelí je situace ještě mnohem složitější, než pro dosud probírané binární slitiny a ocelím budeme věnovat zvláštní kapitolu.
8. Tření.
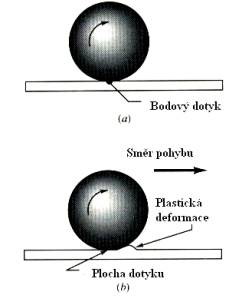
Ze zkušenosti víme, že vyrobit ideálně hladký povrch
pevné látky bude asi dosti obtížné, ne-li nemožné. I tzv. zrcadlově hladký
povrch kovu se nám při dostatečném zvětšení jeví jako hrbolatý (Obr. 8.1).
Proto posouváme-li po sobě dvě tělesa, budou mezi nimi působit tzv. síly tření. Tyto síly dělíme na síly tření smykového, valivého, řemenového a
vrtného. Z jiného hlediska dělíme tření na tření suché a mokré.

Obr.8.1. 1500 x
zvětšený povrch vyleštěné ložiskové oceli.
8.1. Tření smykové (suché).
Tření smykové vzniká při pohybu jednoho tělesa po
druhém (předpokládáme, že obě plochy jsou rovinné). Pro sílu tření mezi oběma
tělesy platí experimentálně určený Coulombův – Amontův zákon:
Ft
= m.N (8.1)
kde
m je koeficient
tření a N je kolmý tlak, tj. složka
výsledné síly, kolmá k třecí ploše.
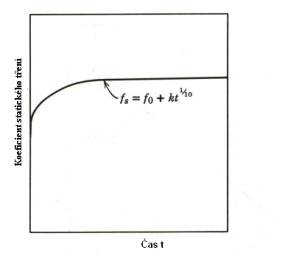
Koeficient tření je funkcí (zřejmě kromě jiných
parametrů) rychlosti vzájemného pohybu obou těles (Obr.8.2 ). Jeho závislost na
době, po kterou obě tělesa na sobě spočívají, je uvedena na Obr.8.3. Na
Obr.8.4.je vynesena závislost síly tření na
čase. Z obrázku plyne z praxe známá zkušenost: táhneme – li např. sáně po umrzlém sněhu,
musíme nejdříve působit dosti velkou silou, než se dají do pohybu. Po překonání
jisté maximální síly při níž se sáně daly do pohybu je síla, potřebná
k jejich dalšímu pohybu již menší.
Obě tyto závislosti lze kvalitativně vysvětlit pomocí
tzv. teorie mikrosvárů. Základní
myšlenka této teorie plyne z Obr.8.5., kde jsou schematicky znázorněny dva
po sobě klouzající povrchy (právě v místech, kde se vzájemně dotýkají
„výstupky“ obou ploch, dochází k tak těsnému kontaktu, že atomy obou
povrchů jsou ve vzájemném kontaktu, a budou na sebe působit meziatomovými
silami – vzniknou mikrosváry)..
V případě kovů je situace komplikována v důsledku heterogenní vrstvy,
která vzniká na jejich povrchu v důsledku oxidace a technologického
zpracování (Obr.8.6. ).
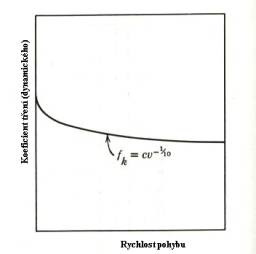
Obr.8.2.
Závislost koeficientu tření
Obr.8.3. Závislost koeficientu tření
na rychlosti pohybu. na čase (do začátku pohybu)
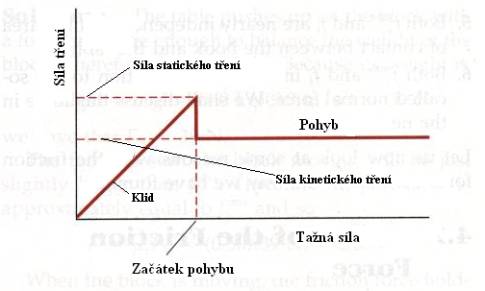
Obr.8.4. Závislost síly tření (koeficientu tření) na tažné síle (čase).
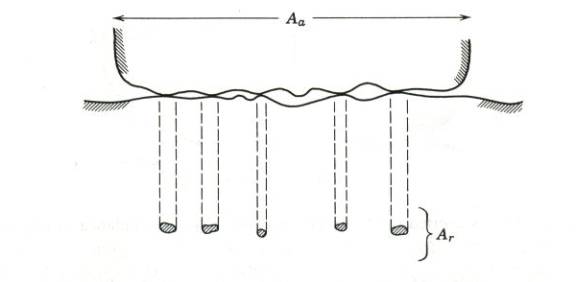
Obr.8.5.
Vzájemný vztah mezi skutečnou a zdánlivou třecí plochou.
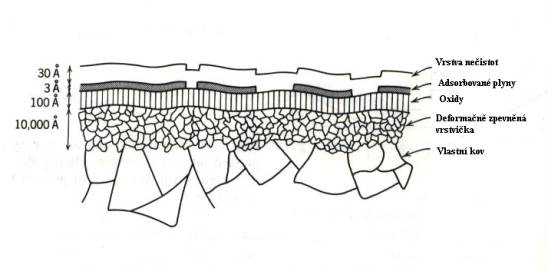
Obr.8.6.
Schematické znázornění složité situace na povrchu kovů.
V Tabulce 8.1. jsou uvedeny koeficienty tření pro
některé v praxi používané dvojice materiálů
Tab.8.1.
|
Materiál |
m |
Materiál |
m |
|
Dřevo – dřevo (suché) |
0,40 |
Kov – kov (olej) |
0,05 |
|
Dřevo – dřevo (namydlené) |
0,20 |
Velmi dobře vyleštěné plochy |
0,03 |
|
Kov – dubové dřevo (suché) |
0,55 |
Ocel – achát (suché) |
0,20 |
|
Kov – dubové dřevo (mokré) |
0,25 |
Ocel – achát (olej) |
0,11 |
|
Kůže - dub |
0,32 |
Ocel – křemen (suché) |
0,50 |
|
Kůže – kov (suché) |
0,56 |
Pneumatika –beton (suché) |
0,70 |
|
Kůže – kov (mokré) |
0,36 |
Pneumatika – beton (mokré) |
0,25 |
|
Kůže – kov (olej) |
0,15 |
Dřevo - kámen |
0,40 |
|
Kov – kov (suché) |
0,17 |
Teflon - teflon |
0,07 |
|
Kov – kov (mokré) |
0,30 |
Nylon - nylon |
0,25 |
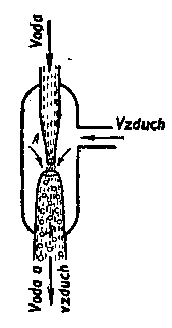
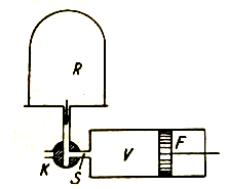
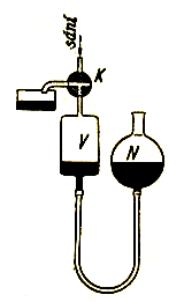
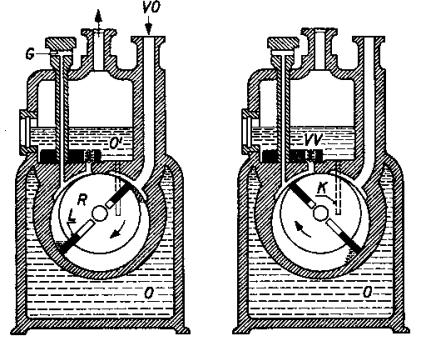
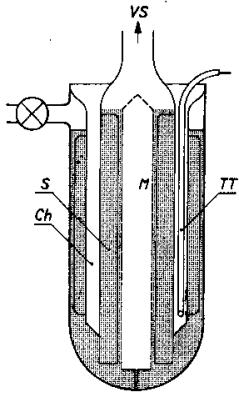
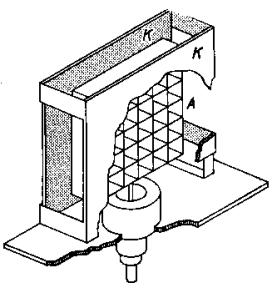
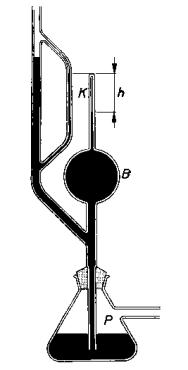
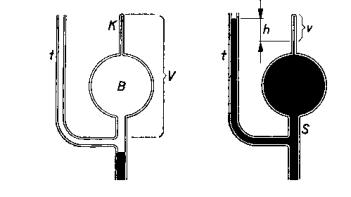
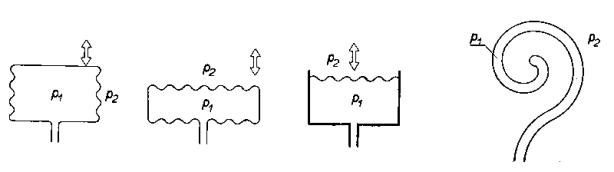
8.2. Měření koeficientu tření.
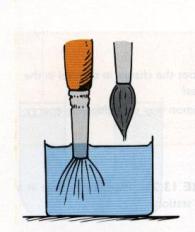
Koeficient tření m lze měřit různými metodami. Některé z nich jsou
uvedeny na Obr. 7,8 a 9 a jejich princip je patrný z obrázků.
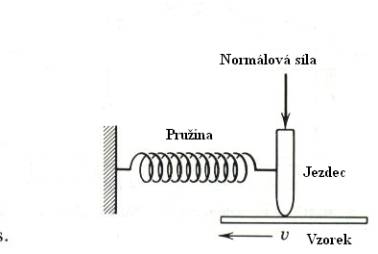
Obr.7. Měření koeficientu tření
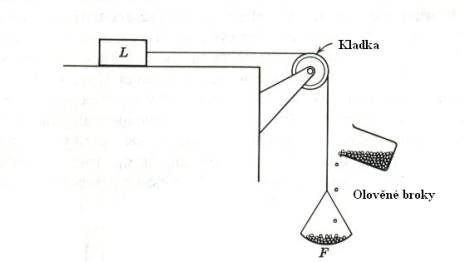
Obr.8. Měření koeficientu tření
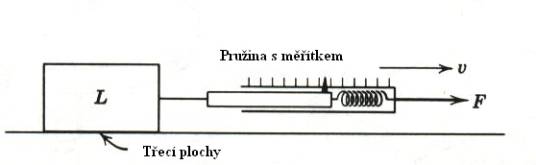
Obr.9. Měření koeficientu tření
Základní zákony suchého tření lze shrnout do několika bodů:
a)
Úměra mezi velikostí
třecí síly a kolmým tlakem je důsledkem skutečnosti, že každá z obou
veličin závisí na materiálových konstantách, charakterizujících obě kontaktní
plochy, násobené toutéž hodnotou skutečné kontaktní plochy AS.
b)
Nezávislost třecí síly
na zdánlivé kontaktní ploše AZ lze objasnit pomocí představy, že to je skutečná a
nikoliv zdánlivá plocha, která řídí interakci mezi oběma tělesy. A tato
skutečná plocha nezávisí na ploše zdánlivé.
c)
Poměrně slabá závislost
třecí síly na rychlosti pohybu obou těles po sobě (Obr.8.2.) souvisí
s malou závislostí mezi napětím a deformací v plastické oblasti
většiny materiálů. Tam, kde je tato závislost výraznější, je výraznější i
závislost třecí síly na rychlosti pohybu.
d)
Slabá závislost třecí
síly na drsnosti třecích ploch (Obr.8.10.) souvisí s tím, že nejvíce
deformační práce se spotřebuje na vyvolání smykového posunutí výstupků na
plochách (na rozdíl od mnohem menší práce, spotřebované na jejich vzájemné
„obcházení“, tj. klouzání po sobě)
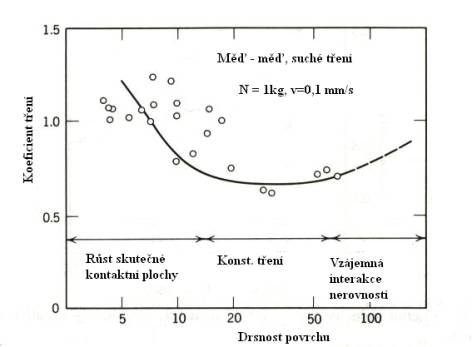
Obr.8.10. Závislost koeficientu tření na drsnosti povrchu.
8.3. Snížení
tření mazáním.
Praxe nám ukazuje, že suché tření lze
značně snížit, použijeme – li maziv. Způsoby mazání můžeme rozdělit do tří skupin:
a)
Mazání pomocí tenkého
kapalného filmu. V ideálním
případě takového mazání jsou obě třecí plochy vzájemně odděleny tenkou vrstvičkou
vhodné kapaliny. Mezera mezi oběma plochami bývá velká ve srovnání
s jejich drsností. Koeficient tření je v tomto případě dán
vlastnostmi mazací kapaliny, zejména její viskozitou. Proto hovoříme o tzv. hydrodynamickém mazání. (Obr.8.11. )
b)
Mazání pomocí
vytvoření povrchové vrstvičky. Tento
způsob mazání spočívá ve vytvoření dvou povrchových vrstviček na obou třecích
plochách tak, aby nedošlo ke vzájemnému kontaktu kovů. Zmíněné vrstvičky jsou
vytvořeny pomocí adsorpce různých maziv (minerální či rostlinné oleje, tuky,
mastné kyseliny, mýdla apod.). Tento způsob mazání se používá většinou při
nižších teplotách a tlacích. Pro vysoké teploty a tlaky se tyto vrstvičky
vytvářejí pomocí různých aditiv,
přidávaných do minerálních olejů (fosfor, chlór a síra). Tak vzniknou poměrně
pevné vrstvičky (soli), které mají vysokou teplotu tání a brání přímému
kontaktu obou kovů mezi sebou.
c)
Mazání pomocí tuhých
maziv. Mezi tuhá maziva řadíme
grafit, sirník molybdenu a teflon. Tyto látky aplikujeme ve formě prášku, který
přilne k oběma třecím plochám a chemicky s nimi reaguje. Posláním
těchto maziv je oddělit od sebe obě třecí plochy prostředím s malým
koeficientem tření. Tohoto způsobu mazání se používá při vysokých teplotách a
tlacích a v agresivním prostředí, kde jsou jiné druhy maziv neefektivní.
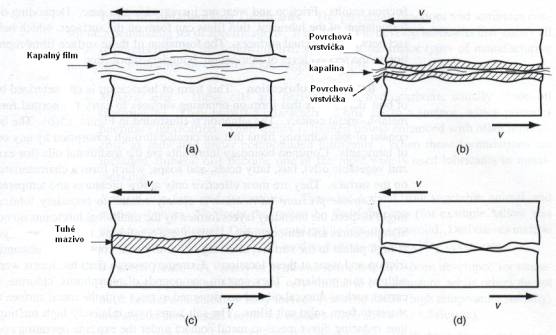
Obr.8.11. Základní principy mazání: a) hydrodynamické, b)
pomocí adsorbovaných
tenkých vrstviček,
c) pomocí tuhých maziv, d) suché tření.
Konkrétní druhy maziv a jejich
vlastnosti :
-
Minerální oleje: Vyrábějí se z ropy a vytvářejí na povrchu
třecích ploch tenké povrchové vrstvičky. Jsou velmi rozšířené.
-
Rostlinné oleje, tuky
a jejich deriváty: Vyrábějí se z rostlin a zvířecích tuků.
Patří k prvním používaným mazivům. Řadíme k nim i mýdla, tuky, vosky
a mastné kyseliny.
-
Syntetická kapalná
maziva: Většinou jsou svojí
strukturou podobné olejům. Patří sem syntetické estery a silikonové oleje.
Používají se za vysokých teplot.
-
Kompozitní maziva: Sem řadíme
minerální oleje, doplněné tzv. aditivy, kterými jsou: (1) sloučeniny fosforu,
síry a chlóru. (2) Pevné látky, jako grafit a sirník molybdenu. (3) Oxidační
inhibitory. (4) Přídavky, zamezující pěnění. (5) Přídavky proti množení
bakterií a jiných organismů.
-
Vodní maziva: Voda je sama o sobě špatné mazivo, avšak přidáme – li
do ní vhodné látky, můžeme ji k mazání použít, neboť má dobré chladící
schopnosti. Jako přísady můžeme použít olej (emulze s vodou), nebo i jiné
speciální chemikálie, rozpustné ve vodě.
-
Povrchové vrstvy: Povrchy třecích ploch lze pokrýt například (1) kovy
(Zn, Sn apod.), které na nich vytvářejí plastické povlaky. (2) polymery
(teflon). (3) skla (pro vysoké teploty.
Obecně lze říci, že nejlepší maziva mají takovou
strukturu, že jejich molekuly jsou tvořeny dlouhými řetězci, ukončenými
nenasycenou vazbou (která se naváže na jednu z ploch). Mazací účinek potom
připomíná „klouzán퓨po mokré trávě. (Obr.8.12)
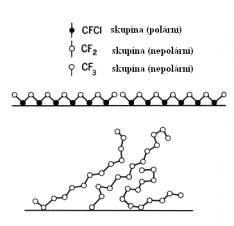
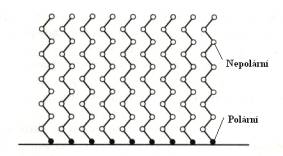
a) b)
Obr.8.12. Princip mazání: a) nepříliš efektivní maziva, b)
velmi dobrá maziva.
8.4. Mokré (vazké) tření.
Z předcházejícího odstavce plyne, že použití
kapalin jako maziv značně snižuje tření obou
třecích ploch. Názorně si to lze představit tak, že se po sobě již
nepohybují obě plochy, ale tenké vrstvičky kapaliny (maziva) – tzv. mokré tření. Podobně je tomu
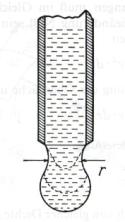
v případě, že se v nějaké kapalině pohybuje těleso (např. kulička o
poloměru r). V obou případech
pozorujeme, že statické tření je nulové (obě třecí plochy se po sobě začnou
pohybovat už při působení nepatrné síly). Je to rozdíl proti suchému tření, u
kterého bylo třeba působit jistou (někdy dosti značnou silou), aby se tažené
těleso dalo do pohybu (viz Obr. 8.4.).
Závislost síly mokrého tření na rychlosti je
schematicky znázorněna na Obr. 8.13 .
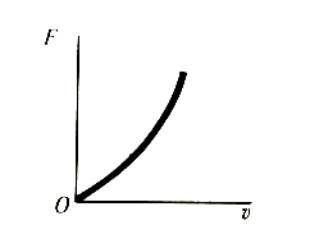
Obr. 8.13. Schematická závislost síly mokrého tření na
rychlosti.
Matematicky
lze tuto závislost popsat Stokesovým vztahem
Ft = 6.p.h.r.v = b.v (8.2)
Kde
h je vazkost
kapaliny a r je charakteristický rozměr
těles (poloměr kuličky, vzdálenost třecích ploch, apod.). Z Obr.8.13.
plyne, že pro větší rychlosti se přímá úměrnost změní na kvadratickou závislost
(Newtonův vztah):
Ft = C.v2 (8.3)
8.4. Valivé tření.
V předcházejících odstavcích jsme si ukázali, že
suché tření lze snížit např. výběrem vhodných materiálů pro třecí plochy, nebo
mazáním. Další cestou je použití valivých ložisek, tj. přeměnou suchého nebo
mokrého tření na tření valivé.
Při valivém pohybu pevného oblého tělesa (kuličky,
válečku) po jiném pevném tělese, k němuž je oblé těleso přitlačováno
nějakou silou (a navíc tlačeno ve směru, rovnoběžném s rovinou druhého
tělesa), odporuje tomuto pohybu tzv.
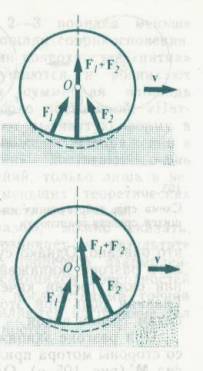
tření valivé. Fyzikální podstatu valivého tření lze objasnit pomocí
Obr.8.14. a 8.15. Protože na kuličku (váleček) působí síla, která ji vtlačuje
do podložky (a zároveň ji pohání jedním směrem, což je typické pro praktické
využití jako kuličková nebo válečková ložiska), dojde k deformaci jak
kuličky, tak i podložky. Pokud by tato deformace byla ideálně pružná,
nevznikala by síla valivého tření. Celková síla, působící na kuličku, je podle
tohoto obrázku rovna F = F1 + F2 a momenty těchto sil vzhledem k ose kuličky se
navzájem vyruší. Výslednice F je v rovnováze s vnější silou, působící na
kuličku (zvětšenou o její tíhu). Nevzniká tedy žádná síla valivého tření.
Obr.8.14. K objasnění valivého tření. Obr.8.15. Síly
při valivém tření.
Protože je tato deformace plastická (i když velmi
malá), vzniká síla valivého tření a síly F1 a F2 budou různé, takže jejich výslednice bude mít složku
vertikální i horizontální. Momenty obou sil mají opačný směr a nerovnají se
jeden druhému. Moment síly F2, brzdící otáčení kuličky je větší, než moment síly F1, který ji urychluje, takže výsledkem je zpomalování rotace kuličky a
tedy vznik valivého tření.
Síla valivého tření je tedy důsledkem nepružného
charakteru deformace kuličky (válečku) a povrchu ložiska v okolí jejich
vzájemného kontaktu. Vztah pro sílu valivého tření má tvar
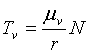 (8.4)
(8.4)
( mv je
koeficient valivého tření, r je poloměr
kuličky a N je kolmý tlak, který na ni
působí)..Hodnota koeficientu valivého tření mv (v cm) je
vždy menší, než je koeficient suchého tření, například (viz Tab.8.2):
|
Dvojice materiálů |
mv (cm) |
|
Tvrdé dřevo – tvrdé dřevo |
0,05 |
|
Ocel - ocel |
0,005 |
|
Ocelové kuličky v ložiskách |
0,0005 – 0,001 |
Odtud
vidíme, jak je vhodné převádět suché i mokré tření na tření valivé; (je –li to
možné).
Zákony
valivého tření lze opět shrnout do několika bodů:
a)
Síla valivého tření je
rovna mocnině zatěžovací síly. Pro malá zatížení, kdy jke deformace kuličky i
podložky prakticky pouze pružná, je exponent mocniny ~ 1,3.
Pro velká zatížení, kdy již plastická deformace na styku kuličky a plochy není
zanedbatelná je exponent větší, dosahuje až hodnot 2,0.
b)
Síla valivého tření je
nepřímo úměrná poloměru křivosti kuličky (válečku).
c)
Síla valivého tření je
tím menší, čím hladší jsou oba povrchy (kuličky i povrchu ložiska).
9. Povrchové napětí kapalin. Povrchová energie
pevných
látek. Tekuté
krystaly.
9.1. Povrchové napětí kapalin.
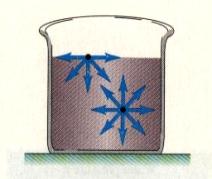
Kapalné skupenství látek je s jedné strany ohraničeno skupenstvím pevným a s druhé strany skupenstvím plynným. Proto je přirozené očekávat, že kapaliny budou mít vlastnosti a strukturu, nacházející se někde mezi uspořádanými pevnými látkami a chaotickými plyny. Hustota kapalin se příliš neliší od hustoty pevných látek (kde se atomy nacházejí v těsné blízkosti) a proto i v kapalinách budou tyto částice (atomy nebo molekuly) dosti blízko u sebe, ale přitom nebudou na sebe vázány tak velkými silami jako v pevných látkách (proto kapaliny nemají stálý tvar), ale přesto ještě dosti velkými (takže kapaliny udržují svůj objem)..
Podle Frenkela připomíná pohyb částic v kapalinách pohyb kočovníků: částice poskočí o malý úsek, chvíli kmitá na místě a opět poskočí náhodným směrem a zase kmitá, atd.
Vyjdeme-li tedy z tohoto kvalitativního modelu kapaliny a vybereme-li si jednu částici uvnitř kapaliny, můžeme říci, že výslednice meziatomových (nebo mezimolekulárních) sil, které na ni působí, je nulová. Zcela jinak je tomu blízko povrchu a na povrchu kapaliny. Tam je výslednice sil, působících na částici nenulová a směřuje dovnitř kapaliny (Obr.9.1). Situace je tedy taková, jakoby byla kapalina stlačena silou, působící směrem dovnitř kapaliny. Ta síla je, ač se to na první pohled nezdá, značná – kapalina je stlačena tak, že se jeví navenek jako téměř nestlačitelná. Jinými slovy to znamená, že na povrchu kapaliny je něco, co připomíná tenkou elastickou blanku, snažící se co nejvíce zmenšit svůj povrch (Obr.9.2).