Kineticko-spektrofotometrické stanovení askorbové kyseliny
Teorie:
Kinetické metody chemické analýzy
Kinetickým metodám chemické analýzy (tj. metodám aplikujícím zákonitosti chemické kinetiky pro účely chemické analýzy) je v literatuře v poslední době věnována značná pozornost. Stejně jako ostatní metodiky analytické chemie nejsou ani kinetické metody obecně použitelné pro jakékoliv analýzy a to jak anorganických, tak i organických látek. Existuje však řada stanovení, kde kinetický způsob řešení je výhodnější než využití rovnovážných metod. Nelze také opomenout tu skutečnost, že výzkum v oboru kinetických metod nutně vede k podrobnému poznání mechanismu analyticky důležitých reakcí, čímž se rozšiřují základní znalosti nutné k dalšímu rozvoji analytické chemie.
Kinetické metody analytické chemie lze rozdělit na několik oblastí:
Chemické reakce s indukční periodou, Landoltův efekt
Některé katalytické reakce jsou charakteristické tím, že jsou provázeny tzv. indukční periodou. Indukční perioda je určitý časový úsek od smíchání výchozích látek, během něhož reakce zdánlivě neprobíhá. Tento efekt jako první pozoroval Landolt při studiu reakce jodičnanu se siřičitanem v kyselém prostředí. Produktem této reakce při přebytku jodičnanových iontů je jod, jehož tvorbu je možno vizuálně sledovat. K tvorbě jodu však dochází až po určité inkubační periodě. Po svém objeviteli se tento jev nazývá Londnův efekt. Existuje celá řada pomalých reakcí, u nichž se projevuje Landoltův efekt. Většinou jde o děje oxidačně-redukční, ve kterých reagují halogeny v různých oxidačních stupních. Méně často byl Landoltův efekt pozorován při reakcích acidobazických nebo při reakci komplexů. Všeobecně se předpokládá, že ke vzniku indukční periody dochází u reakcí, které probíhají ve dvou nebo více krocích.
Kineticko-spektrofotometrické stanovení askorbové kyseliny
Analytická metoda používaná v této laboratorní úloze (kineticko-spektrofotometrické stanovení askorbové kyseliny) je založená na inhibičním vlivu askorbové kyseliny na reakci mezi bromičnanem a kyselinou chlorovodíkovou. Produkty této reakce odbarvují methyloranž, což může být sledováno spektrofotometricky při vlnové délce 510 nm.
Reakce probíhá v několika krocích:
Nejprve bromičnan reaguje s kyselinou chlorovodíkovou podle následující reakce:
10 Cl– + 2 BrO3– + 12 H+ ==== 5 Cl2 + Br2 + 6 H2O (a)
Reakcí vzniklý brom a chlor reagují s methyloranží a tato reakce způsobuje odbarvení methyloranže dle následující reakce:
–O3S–C6H4–N=N–C6H4–N(CH3)2 + X2 + H2O (červená) ====
HO–C6H4–N(CH3)2 + –O3S–C6H4X + N2 + X– + H+ (bezbarvá) (b)
(X = Cl nebo Br)
Tato rekce může být sledována spektrofotometricky měřením poklesu absorbance reakční směsi při 510 nm. Askorbová kyselina přednostně reaguje s produkty reakce (brom, chlor), což způsobuje vznik indukční periody (odpovídá času potřebného na zreagování přítomné askorbové kyseliny). Až je askorbová kyselina z roztoku vyčerpána, využije se další vznikající brom a chlor na rekci s methyloranží, která se odbarvuje. Indukční perioda vzrůstá s koncentrací askorbové kyseliny.
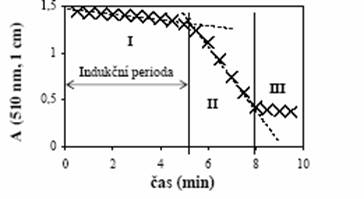
Závislost absorbance na čase má typický tvar (viz obrázek č. 16):
Obrázek č. 16
Závislost absorbance na čase

Vidíme, že graf závislosti absorbance na čase má 3 části:
I Indukční periodu (tj. A je přibližně konstantní)
II Průběh reakce (b) (pokles A s časem)
III Z analytického hlediska nezajímavou část (A = 0, pokud již přítomný brom a chlor rozložily veškeré přítomné barvivo).
Hodnotu indukční periody získáme tak, že lineárním úsekem části I a II grafu vedeme přímku. Čas odpovídající průsečíku těchto přímek je indukční perioda (viz obrázek č. 16).
Závislost indukční periody na koncentraci askorbové kyseliny při 25 oC (naměření této závislosti je časově poměrně náročné a přesahuje možnosti základního laboratorního cvičení) byla experimentálně stanovena a je uvedena na obrázku č. 17.
Obrázek č. 17
Závislost indukční periody na koncentraci askorbové kyseliny
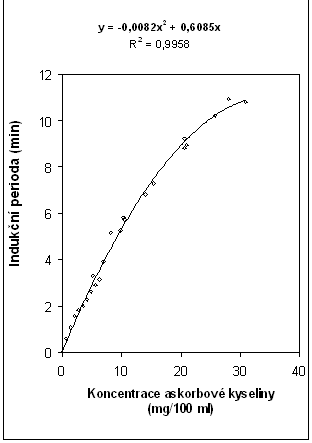
Z výše uvedeného obrázku je zřejmé, že kalibrační závislostí nemusí vždy být přímka.
Výpočet koncentrace askorbové kyseliny ze stanovené indukční periody provedeme řešením kalibrační funkce, tj. kvadratické rovnice:
t = – 0,0082 c2 + 0,6085 c
kde
t . . . . indukční perioda (min),
c . . . . koncentrace askorbové kyseliny (mg/100 ml).
Úkol:
1) Kineticko-spektrofotometrickou metodou stanovit obsah askorbové kyseliny ve vybraném vitaminově obohaceném nápoji (vzorek si do cvičení přinese posluchač)
a ve farmaceutickém preparátu (na začátku semestru si jedno balení opatří celá laboratorní skupina).
2) Srovnáním vlastních výsledků s výsledky jiných posluchačů se pokusit vyjádřit ke stabilitě askorbové kyseliny v různých vitaminově obohacených nápojích a ve farmaceutickém preparátu.
Pomůcky:
Chemikálie:
Postup:
1. Zapneme spektrofotometr a nastavíme vlnovou délku 510 nm. Přístroj necháme zahřát.
2. Podle údajů výrobce zjistíme teoretický obsah askorbové kyseliny ve vzorku (mg/100ml). Pokud máme analyzovat tuhý farmaceutický preparát, nejprve jej kvantitativně převedeme do roztoku (u šumivých tabletek rozpuštěním tabletky ve
100 ml destilované vody v odměrné baňce).
3. Jodometrickou titrací zjistíme přibližnou koncentraci askorbové kyseliny ve vzorku:
Napipetujeme 5 ml vzorku do kádinky, přidáme kapátkem asi 0,5 ml roztoku škrobu a dolijeme destilovanou vodu na objem asi 30 ml. Do kádinky vložíme míchadélko, kádinku postavíme na míchačku a zapneme míchání. Dělenou pipetou o objemu 1 ml pomalu po kapkách přidáváme odměrný roztok jodu a sledujeme zbarvení roztoku. Při změně zbarvení (zmodrá) titraci ukončíme a zapíšeme si přidaný objem roztoku jodu.
Poznámka:
a) Pozor, v barevných vzorcích ovocných šťáv nemusí být barevný přechod vždy jasně pozorovatelný a výsledné zbarvení nemusí být modré.
b) Práce s pipetou o objemu 1 ml je náročná na experimentální zručnost. Je proto vhodné před titrací si práci s touto pipetou nejprve nacvičit.
Titraci opakujeme 3x. Z průměrné spotřeby vypočteme koncentraci askorbové kyseliny ve vzorku. Potom zředíme vzorek na očekávanou koncentraci askorbové kyseliny asi
7 mg/100 ml. Výpočet si necháme zkontrolovat.
4. Nyní stanovíme koncentraci askorbové kyseliny v předředěném vzorku kineticko-spektrofotometrickou metodou:
Do kyvety o optické délce 10 mm napipetujeme 1,6 ml roztoku methyloranže v HCl. Mikropipetou přidáme 200 µl zředěného roztoku vzorku (pipetu po vytlačení vzorku v kyvetě důkladně propláchneme tím, že při ponořené špičce několikrát stiskneme ovladač do polohy 1 a uvolníme). Pak kyvetu umístíme do držáku kyvet ve spektrofotometru a zapneme režim automatického měření po 15 sekundách. Do mikropipety nabereme 200 µl roztoku KBrO3 o koncentraci 1,44.10–3 mol/l. Přesně v okamžiku zvukového signálu přístroje vyprázdníme obsah pipety do kyvety a obsah kyvety promícháme tím, že špičku v roztoku v kyvetě 10x propláchneme (celá operace smí trvat nanejvýš 10 sekund). Pak uzavřeme spektrofotometr a po každém zvukovém signálu opisujeme absorbanci tak dlouho až výrazně klesne a pokles se zastaví (asi
10 – 20 minut).
Ze získaných hodnot sestrojíme graf závislosti absorbance na čase a odečteme z něj indukční periodu jako čas, ve kterém se protínají první dvě přímkové části grafu. Dosazením indukční periody do kalibrační rovnice vypočteme koncentraci askorbové kyseliny ve zředěném vzorku a pak ve vzorku původním. Měření kineticko-spektrofotometrickou metodou 3x opakujeme, každé měření vyhodnotíme zvlášť
a vypočteme průměrnou koncentraci.
Protokol:
1. Přesné informace výrobce o zkoumaném vzorku (název výrobku, složení, teoretický obsah askorbové kyseliny, záruka, datum výroby, přesný čas otevření, výrobce.
2. Obsah askorbové kyseliny stanovený jodometrickou titrací.
3. Ze získaných dat sestrojit graf závislosti absorbance na čase a odečíst z něj indukční periodu.
4. Dosazením indukční periody do regresní rovnice vypočítat koncentraci askorbové kyseliny ve zředěném vzorku a pak ve vzorku původním.
5. Každé měření kineticko-spektrofotometrickou metodou vyhodnotit zvlášť a vypočítat průměrnou koncentraci.
6. Srovnat výsledek stanovení jodometrickou titrací s kineticko-spektrofotometrickou metodou a údajem výrobce.
Literatura:
Zýka J. a kol.: Analytická příručka II díl, SNTL, Praha 1988.
Cídlová H. a Jančář L.: Kineticko-spektrofotometrické stanovení askorbové kyseliny, Chem. Listy 96, 486 (2002).
Cídlová H.: Vitamín C - pohled do historie. Chemický občasník 5, Pedagogická fakula MU, Paido, Brno, 1997.
Ensafi A.A., Rezaei B., Movadehinia H.: Kinetic-Spectrofotometric Determination of Ascorbic Acid by Inhibition of the Hydrochloric Acid-Bromate Reaction. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 58, 2589-2594 (2002).