Pexeso – V laboratoři jako doma
![]()
Hana Cídlová,
Eva Lomovcivová, Emílie Musilová
Katedra
chemie Pedagogické fakulty Masarykovy univerzity, Česká republika
e-mail:
cidlova@centrum.cz
Milí přátelé!
Připravily jsme pro Vás zábavnou hru – pexeso. Kromě zábavy Vám přinese i poučení a snad Vás i sblíží s jedním vědním oborem – chemií. Hra se skládá z 64 obrázkových kartiček, na kterých je zobrazeno 32 situací, se kterými (nebo s jejich důsledky) se setkáváme v běžném životě. Každá situace je ve hře zobrazena dvakrát. Jednou na vybarvených kartičkách (svět kolem nás), podruhé na víceméně černobílých kartičkách (provedení dané činnosti v laboratoři nebo chemická reakce popisující probíhající děj). Základním principem hry je hledání dvojic patřících k sobě (jsou označeny stejným číslem a stejným názvem kartičky). Při jejich hledání rozvíjíte svoji obrazovou paměť, umění soustředit se a hravou formou získáváte nové vědomosti. Nůžkami nejprve pečlivě vystříhejte jednotlivé kartičky s obrázky a pozorně si přečtěte pravidla hry.
Pravidla hry
1. Počet hráčů: 2 a více.
2. Kartičky zamíchejte a rozložte lícem dolů (aby obrázky nebyly viditelné) do libovolného obrazce.
3. Dohodněte se, v jakém pořadí budete hrát.
4. Začínající hráč otočí dvě libovolné kartičky lícem nahoru tak, aby obrázky z nich jasně viděli všichni spoluhráči. Když se mu podaří najít dvojici obrázků patřících k sobě, ponechá si obě dvě kartičky a pokračuje ve hře. Když ne, obě kartičky vrátí na původní místa lícem dolů. Ve hře pak pokračuje další hráč.
5. Hra končí, když na hrací ploše nezůstane žádná kartička. Každý hráč si spočítá nalezené dvojice kartiček. Za každou dvojici získává jeden bod.
6. Vítězem je ten, kdo získal nejvíc bodů.
Doplněk k pravidlu č. 6 (pro hráče starší 12 let):
Pokud při počítání dvojic kartiček hráč správně odpoví na otázku k příslušné dvojici kartiček (viz seznam otázek), získává za tuto dvojici obrázek další bod. Celkem tedy za nalezenou dvojici kartiček může získat dva body. Pokud hráč neodpoví správně, získává pouze jeden bod za nalezení kartiček. Seznam správných odpovědí je uveden za seznamem otázek.
Přejeme Vám příjemnou zábavu!
Seznam otázek:
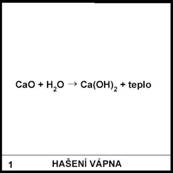
1)
Hašení vápna je poměrně nebezpečné. Proč člověk na obrázku musí
mít brýle?
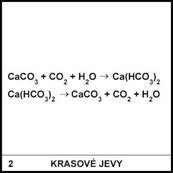
2)
Proč se v krasových jeskyních nemá sahat na rostoucí
krápníky?
3)
Napiš vzorec ethanolu a vzorec methanolu. Který z nich je
nebezpečnější?
4)
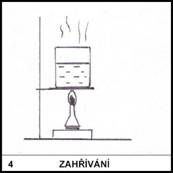
Proč se na plynovém sporáku dává pod pánvičku síťka a
v chemické laboratoři se dává síťka pod zahřívanou kádinku?
5)
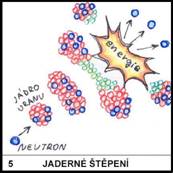
Jaké je mírové využití jaderných reakcí?
6)
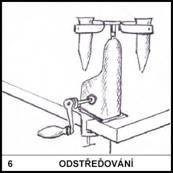
Jak se jmenuje laboratorní přístroj umožňující odstřeďování vzorků
při velmi vysoké frekvenci otáčení?
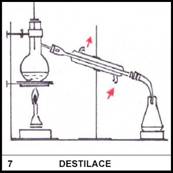
7)
Na obrázku je zdrojem tepla při destilaci kahan. Je bezpečné použít
kahan při destilaci ethanolu?
8)
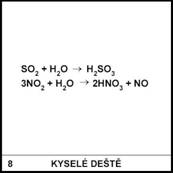
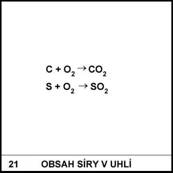
Jak by se daly omezit
emise SO2, NOx, CO2?
9)
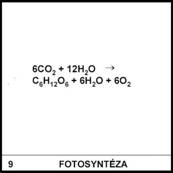
Proč je fotosyntéza důležitá?
10)
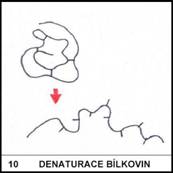
Při jaké teplotě dochází k nevratné denaturaci bílkovin?
11)
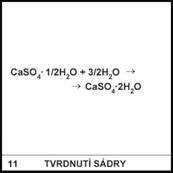
Chemickým a
mineralogickým názvem pojmenujte CaSO4·1/2H2O.
12)
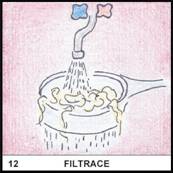
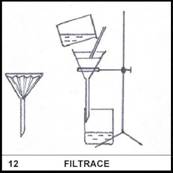
Co je to filtrace?
13)
Která chemická látka
vzniká polymerací monochlorethenu (vinylchloridu) znázorněnou na obrázku?
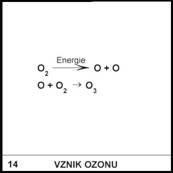
14)
Je ozon užitečný?
Proč?
15)
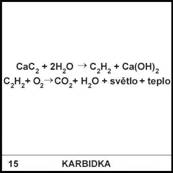
Látce CaC2
se sice dříve říkalo karbid (proto
název lampy karbidka), jeho správný
chemický název je však jiný. Jaký?
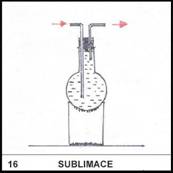
16)
Co je to sublimace?
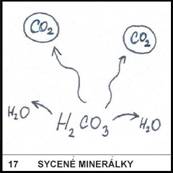
17)
Je kyselina uhličitá H2CO3
stabilní při vysokém tlaku, nebo při nízkém?
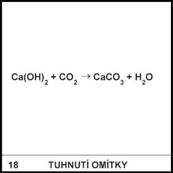
18)
Omítka nebo malta
snadněji tuhne, je-li sucho, teplo a větrno. Proč?
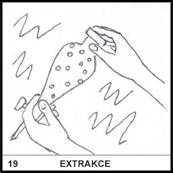
19)
Co je to extrakce?
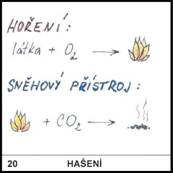
20)
Jaký je princip
uhašení ohně sněhovým hasicím přístrojem?
21)
Hořením vzniklý SO2
může zreagovat s vodou a za určitých okolností se produkt může usadit
v komíně. Jaký to pro komín bude mít důsledek?
22)
Sklo i křemen mají
sice v podstatě stejné složení (SiO2), ale úplně jinou
strukturu. Jak je to možné?
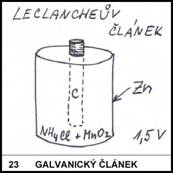
23)
Napište chemickou
reakci probíhající v LeClancheově článku.
24)
Jakou nepříjemnou
vlastnost má CO? V jaké situaci a prostředí dochází často k otravám
oxidem uhelnatým?
25)
Jaký význam má DNA?
26)
Jako chladicí směs se
někdy používá směs ledu a kuchyňské soli. Jaké nejnižší teploty lze pomocí této
směsi dosáhnout?
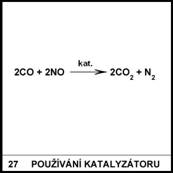
27)
Co je to katalyzátor?
28)
Jaký je význam jaderné
fúze?
29)
Jaký je chemický
vzorec glycerolu?
30)
Jaký je správný
chemický název látky se vzorcem H2S?
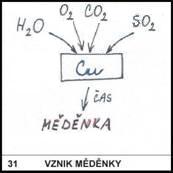
31)
Jakou barvu má měď a
jakou barvu má měděnka?
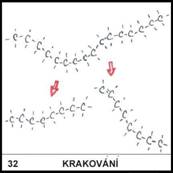
32)
K čemu slouží
krakování?
Seznam odpovědí:
1)
Při hašení vápna vzniká hydroxid vápenatý, tedy žíravina. Protože
se při reakci uvolňuje velké množství tepla, obsah nádoby se rozstřikuje.
Člověk na obrázku má mít brýle. Pokud by mu vznikající hydroxid vnikl do oka,
hrozí mu ztráta zraku.
2)
Na krápníku by mohla ulpět mastnota z našich rukou. Tím se
změní povrchové napětí mezi povrchem krápníku
a roztokem Ca(HCO3)2 stékajícím po povrchu krápníku.
Roztok Ca(HCO3)2 stéká po mastném povrchu rychleji
a nedochází k odpařování vody přímo na krápníku. Tím na krápníku nezůstává
CaCO3 a krápník přestane růst.
3)
ethanol: C2H5OH, methanol: CH3OH.
Nebezpečnější je methanol (25 g methanolu usmrcuje člověka o hmotnosti 70 kg).
ethanol je složkou alkoholických nápojů, např. vína.
4)
Síťka rozptýlí plamen, takže dno pánvičky nebo kádinky je
zahříváno rovnoměrně. U pánvičky tak zařídíme rovnoměrné smažení na všech
jejích místech, kádinku rovnoměrným zahříváním na větší ploše chráníme před
prasknutím.
5)
Při jaderných reakcích se uvolňuje velké množství energie. Toho se
využívá v jaderných elektrárnách. Vyhořelé jaderné palivo je možno
využít jako zdroj různých radioaktivních izotopů.
6)
Centrifuga.
7)
Použití přímého plamene při destilaci ethanolu bezpečné není,
protože ethanol je hořlavý. Pro jeho destilaci je vhodné použít elektrický
zdroj tepla, např. topné hnízdo.
8)
Použitím vhodných
absorpčních filtrů. Protože všechny uvedené oxidy jsou kyselinotvorné, je možno
je zneškodnit reakcí s hydroxidem, např. s Ca(OH)2 (hašené
vápno).
9)
Při fotosyntéze vzniká kyslík (je nezbytný k dýchání). Také
při fotosyntéze vznikají z anorganických látek látky organické
(fotosyntetizující rostliny jsou jediným zdrojem potravy pro téměř všechny
ostatní organismy).
10)
Vyšší než 60oC.
Tuto teplotu snadno hmatem poznáme – je to nejnižší teplota, kdy nás zahřátý
předmět začne nesnesitelně pálit).
11)
Chemický název:
hemihydrát síranu vápenatého. Mineralogický název: sádrovec.
12)
Filtrace je oddělování
složek směsi na základě odlišné velikosti částic. K dělení dochází na
filtru, který částice do určité velikosti propustí, zatímco větší částice
zadrží.
13)
Polyvinylchlorid
(PVC).
14)
V horních
vrstvách atmosféry je ozon velmi užitečný, protože zachycuje UV záření, které
by jinak při dopadu na Zemi ničilo chemické vazby v organických látkách (např.
v DNA) a vážně tím ohrožovalo život. Ozon je však jedovatý (vzniká např.
v blízkosti xeroxu, takže v místnosti s běžící kopírkou musíme
větrat). Jedovatosti ozonu se využívá k hubení mikroorganismů (tzv.
ozonizace).
15)
CaC2 je
odvozen od látky C2H2 (ethyn neboli acetylen). Kationty H+
se od acetylenu C2H2 poměrně snadno odštěpí a
vznikne anion C22–, nazývaný acetylid. Jeho sůl CaC2
je tedy acetylid
vápenatý.
16)
Sublimace je přímá
přeměna pevné látky na plyn.
17)
Každý ze zkušenosti
ví, že při otevření nápoje syceného CO2 láhev zasyčí (poklesne
v ní tlak) a z nápoje začnou unikat bublinky CO2. Snížení
tlaku v láhvi tedy vede k rozkladu H2CO3 na H2O
a CO2. Kyselina uhličitá je tedy stabilní jen při vysokém tlaku.
18)
Vysoká teplota a sucho
usnadňují vypařování vody, která je pak větrem odváta od omítnuté zdi. Tím se
poruší rovnováha v reakci napsané na kartičce a proběhne děj uvolňující
další vodu, tedy současně i vznik nerozpustného CaCO3, což je
podstatou tvrdnutí omítky nebo malty.
19)
Extrakce je metoda
oddělování látek na základě jejich rozpustnosti ve vhodném rozpouštědle.
20)
Na hořící látce se
vytvoří vrstva CO2, je tedy vypuzen kyslík a hoření (tj. slučování
látek s kyslíkem) nemůže probíhat.
21)
Reakcí SO2
s vodou vzniklá kyselina siřičitá způsobí korozi zdiva a to se začne
rozpadat.
22)
Jedná se o polymorfii
(schopnost téže sloučeniny mít různé krystalové vlastnosti). Krystaly křemene
vznikají pomalým chladnutím roztaveného SiO2, zatímco amorfní sklo
vzniká rychlým ochlazením roztaveného SiO2.
23)
Zn + 2NH4+
® Zn2+ + H2
+ 2NH3
24)
CO je smrtelně
jedovatý, je však bezbarvý a bez zápachu. Jeho přítomnost je tedy velmi obtížné
včas ujistit. Vzniká při nedokonalém spalování (tedy při hoření za
nedostatečného přístupu vzduchu. Kromě některých chemických výrob vzniká oxid
uhelnatý např. při hoření paliva v autě. Otrava oxidem uhlenatým tedy
hrozí např. tehdy, jsme-li v garáži, máme puštěný motor auta a zavřené
dveře od garáže.
25)
Kóduje genetickou
informaci
26)
–21oC.
27)
Katalyzátor je látka,
která výrazně urychluje chemickou reakci, ale sama se přitom nespotřebovává.
28)
Při jaderné fúzi se
uvolňuje velké množství energie (zdroj zářivé energie hvězd). Průmyslově se ji
zatím nepodařilo využít.
29) CH2–CH–CH2
| | |
OH OH
OH.
30)
Sulfan
31)
Měď je červená,
měděnka je zelená.
32)
Je to úprava dlouhých
uhlovodíkových řetězců na kratší, které jsou od sebe snáze oddělitelné a snáze
zpracovatelné na další látky.
Tvorba hracích karet a publikování tohoto článku byly podporovány
grantem FRVŠ 736/03/G6 „Hrajeme si v chemii“.